引言
2020年注定是不平凡的一年,也将是载入史册的一年。一个不太热门的研究,一下子进入了公众视野,给我们上了一堂沉重的课。那么如何有效防范病毒传播,如何进行专业防控和疫苗研发,这都需要对病毒基本特征和机理深入研究。
然而,由于受到光学衍射极限的限制,普通光学显微镜分辨率只能达到200nm,而通常病毒和亚细胞结构的尺寸只有几十到200多纳米,远远小于普通光镜的分辨率。超高分辨显微技术的出现,为观测这类精细结构提供了可能,因此也得到了越来越广泛的应用。作为超高分辨技术的,受激发射损耗(STimulated Emission Depletion, STED)技术更是在生命科学领域尤其是病毒学相关研究中发挥着重要作用。
本次为大家分享STED技术在病毒学研究中的应用和新进展,助力生命科学研究和发展。
STED基本原理
2014年诺贝尔化学奖授予三位科学家,以表彰他们发明超高分辨显微技术。其中Stefan Hell发明了STED技术,而徕卡公司也是*将其商业化。从2007年开始,徕卡STED产品不断创新和优化,已经拥有近13年的STED技术积累。2014年*推出SP8 STED 3X,即荣获当年的R&D100大奖。2019年更是创新性的推出了τ-STED,进一步在提升分辨率的同时降低了激光功率,更适合活细胞超高分辨成像。
 2014年诺贝尔化学奖获得者,左起分别是:Eric Betzig、Stefan W. Hell、William E. Moerner
2014年诺贝尔化学奖获得者,左起分别是:Eric Betzig、Stefan W. Hell、William E. Moerner
说了这么多,STED技术原理到底是什么呢?很简单。我们想象一下,一个点发射出的荧光信号,被检测后通常是一个衍射斑;如果我们同时使用一个甜甜圈样的激光将其周围的信号擦除掉,只允许中心很小的荧光信号发射出来,这样分辨率不就提高了吗。这个起擦除作用的激光便是STED激光,也叫损耗光,利用的是荧光的受激发射损耗原理。之后,通过对图像的扫描,即可直接呈现超高分辨图像,无需任何后续计算过程。同时,根据公式,可通过增加STED激光功率来提升图像分辨率。
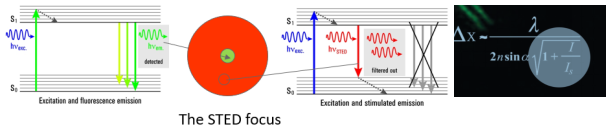 STED原理示意图:STED通过受激发射损耗去除衍射环上的荧光信号,大大缩小有效的激发区域,从而改写了分辨率公式,提高了光学分辨率
STED原理示意图:STED通过受激发射损耗去除衍射环上的荧光信号,大大缩小有效的激发区域,从而改写了分辨率公式,提高了光学分辨率
STED技术在病毒学研究中的应用实例
01
*应用实例,是对病毒精细结构的观察。2012年发表在期刊science上,标题为:荧光纳米显微镜(STED)揭示成熟依赖的HIV-1病毒表面蛋白的再分布特征【1】。
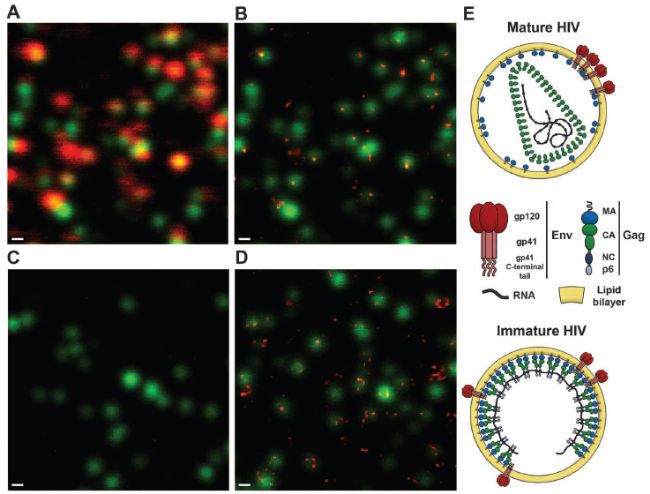
图中绿色代表HIV-1病毒粒子,红色表示病毒表面的膜蛋白。可以看到,通过普通共聚焦无法分辨膜蛋白的具体定位位置,很模糊。包膜糖蛋白gp120(红色)与病毒粒子(绿色)90%共定位,信号模糊,分辨不出细节。而STED成像可以发现,大多数成熟病毒粒子表现出单一的包膜蛋白Env或焦点(图1B),而大多数未成熟粒子表现出两个或两个以上的包膜蛋白Env(图1D)。
02
第二个应用实例,是对病毒成熟过程的观察。标题为:STED纳米显微镜揭示HIV病毒蛋白水解成熟的时间过程【2】。
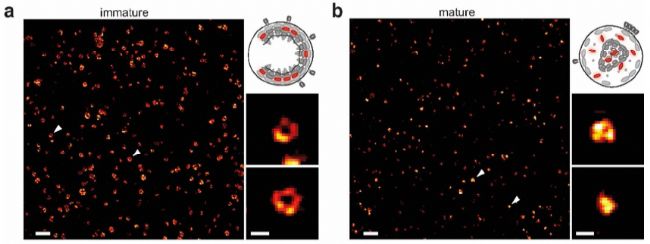
利用STED显微镜发现在HIV-1病毒成熟和未成熟条件下,可非常清晰区分其Gag蛋白的不同结构特征。未成熟病毒的Gag蛋白呈中空环状(图a),而成熟病毒中呈实心固缩状(图b)。

作者巧妙的利用光控方法,进行STED时间序列成像。在400nm紫外光照后,PDI(光催化降解的蛋白酶抑制剂)降解,Gag蛋白能够被蛋白酶水解切割,进而病毒成熟。STED时间序列成像可轻松捕获病毒从未成熟到成熟过程,Gag蛋白重排的结构变化过程。
03
第三个应用实例,是对病毒基因组示踪。标题为:以单分子分辨率示踪宿主细胞中的病毒基因组【3】。
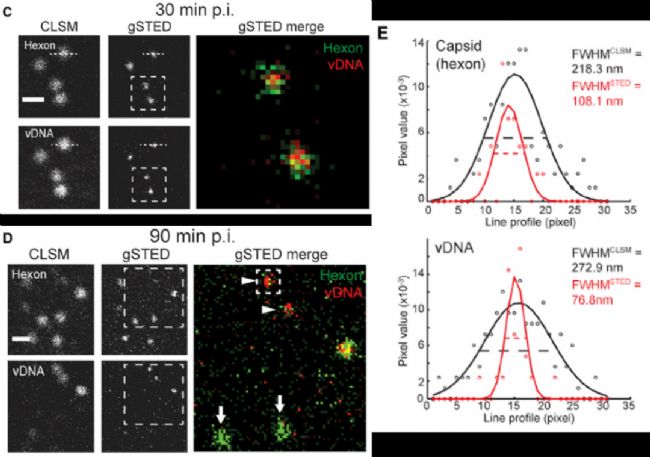
腺病毒DNA通过AF594标记的叠氮点击反应显示,衣壳蛋白通过抗hexon的抗体识别,并且只有在脱壳后,病毒DNA才可以被反应检测到荧光信号。
通过gated STED超高分辨显微成像,可显著提高分辨率,清晰呈现病毒衣壳和DNA的真实尺寸大小。腺病毒衣壳实际大小约80nm,gSTED显示约110nm(包含一二抗尺寸),与实际一致。gSTED显示被衣壳蛋白包裹的病毒DNA尺寸略小于80nm,也与衣壳尺寸符合。
04
第四个应用实例,是对病毒基因组复制的观察。标题为:利用STED超高分辨显微镜观察复制的HSV-1病毒【4】。值得一提的是,本文由中科院昆明动物所周巨民老师课题组与徕卡公司合作完成。

病毒基因组复制是单纯疱疹病毒 1 (HSV-1) 溶解感染周期的重要事件。目前由于检测和观察方法的局限,病毒复制过程的细节仍难以捕捉。为了获得更加详细的 HSV-1 复制机制,本文使用了STED受激发射损耗显微镜,结合荧光原位杂交 (FISH) 和免疫荧光,对HSV-1 复制过程进行了精细观察。
作者设计了位于HSV-1病毒基因组两端的探针,分别以DIG(绿色)和Biotin(红色)进行标记,在病毒复制的早期和晚期,分别成像观察。STED成像发现,在复制的早期,红绿两色信号的共定位程度较高;而在复制后期,两个系数均发生了明显降低,表明HSV-1 基因组在复制过程中经历了从紧凑到松弛的动态结构变化,同时需要占用较大的空间进行复制。
05
第五个应用实例,是对病毒侵染和传播过程捕获的研究。标题为:ARP2和病毒诱导的丝状伪足促进了人类呼吸道合胞体病毒的传播【5】。
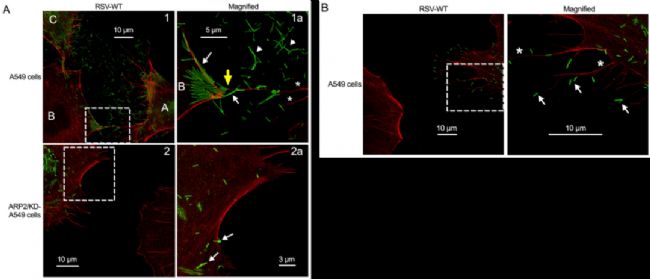
利用STED超高分辨显微镜进行成像,发现感染了RSV病毒的细胞(图A首行,标记为A和C)外存在大量的丝状伪足(红色),且富集有大量病毒颗粒(绿色);暗示可通过丝状伪足将RSV病毒传递给邻近细胞。而在ARP2敲除的细胞中(图A第二行),即便感染了RSV病毒,细胞的丝状伪足数量都大量减少,病毒在细胞间的传播不明显。放大图像(图B),可观察到RSV病毒主要分布在丝状伪足的*,进一步验证了病毒可通过诱导丝状伪足的产生来促进其在细胞间的传播。
如何进一步提高STED分辨率?
根据公式我们可以知道,通过增加STED激光功率就可直接增加图像的分辨率,这个方法简单;但问题是不利于活细胞成像。那么如何在不提高激光功率的前提下,进一步提高STED分辨率呢?有以下三种方法,分别是gated STED,gated STED + Lightning,和徕卡新推出的τ-STED。
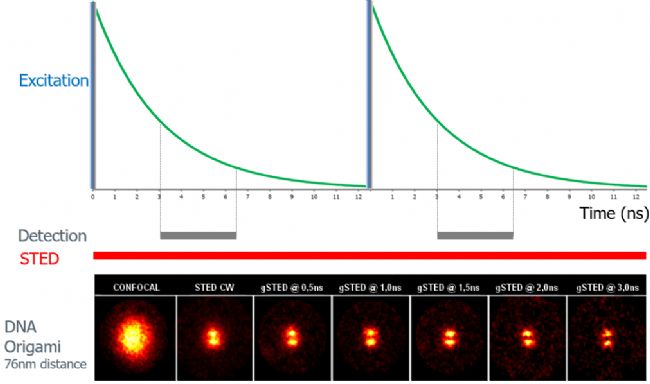
01
以两个距离76nm的DNA Origami为例,gated STED在不改变STED激光功率的前提下,逐步缩小荧光寿命的检测范围,可逐步提高分辨率,清晰地分辨两个点信号。
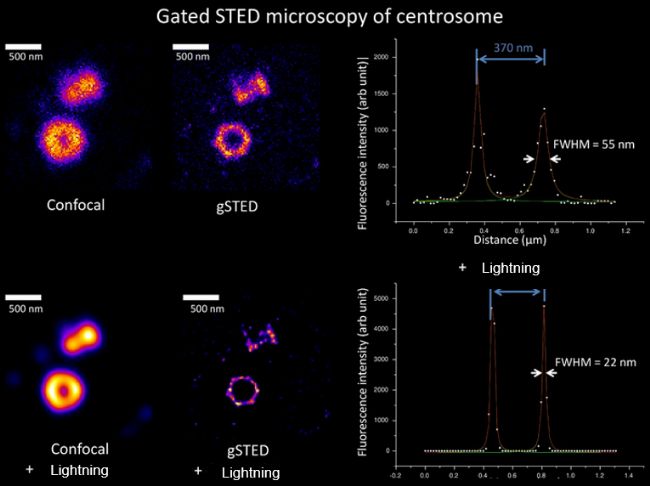
02
对中心粒的gated STED + Lightning成像结果,分辨率(半高宽)可达22nm!
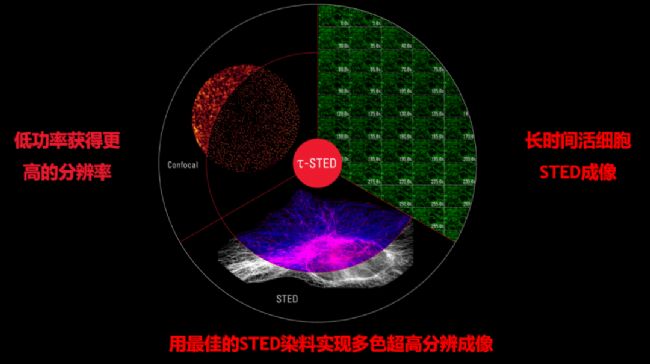
03
新一代STED:τ-STED,即将STED和超快速的荧光寿命相结合,实时呈现超高清分辨图像。它在已有STED优势的基础上,可以更低激光功率获得更高图像分辨率,进一步拓展荧光染料的选择,非常适合长时间的活细胞成像。
结语
徕卡STED拥有13年的研发、技术和服务经验,也具有以下突出优势特点,是病毒学研究的*利器:
此外,整个STED是搭载在徕卡共聚焦平台上的,因此也拥有共聚焦的所有优点。相信徕卡STED超高分辨显微镜能够更多地贡献超高清图像结果,助力病毒学和生命科学研究发展。
参考文献:
【1】Chojnacki J, Staudt T, Glass B, et al. Maturation-dependent HIV-1 surface protein redistribution revealed by fluorescence nanoscopy.[J]. Science, 2012, 338(6106): 524-528.
【2】Hanne J, Gottfert F, Schimer J, et al. Stimulated Emission Depletion Nanoscopy Reveals Time-Course of Human Immunodeficiency Virus Proteolytic Maturation[J]. ACS Nano, 2016, 10(9): 8215-8222.
【3】Wang IH, Suomalainen M, Andriasyan V, et al. Tracking viral genomes in host cells at single-molecule resolution. Cell Host Microbe. 2013;14(4):468–480.
【4】Li Z, Fang C, Su Y, et al. Visualizing the replicating HSV-1 virus using STED super-resolution microscopy[J]. Virology Journal, 2016, 13(1): 65-65.
【5】Mehedi M, Mccarty T, Martin S E, et al. Actin-Related Protein 2 (ARP2) and Virus-Induced Filopodia Facilitate Human Respiratory Syncytial Virus Spread[J]. PLOS Pathogens, 2016, 12(12).
电话
微信扫一扫
