
* 本文转自“非因生物"公众号
肾细胞癌(RCC)具有血管侵袭的生物学倾向,4-15%的病例可形成肾静脉或下腔静脉(IVC)肿瘤血栓(TT)。基于免疫治疗的联合治疗(IBCs)已成为治疗晚期RCC的一线方法。在IBC治疗的背景下,阿西替尼具有半衰期短、反应快、潜在免疫激活等特点,已成为新辅助治疗中疗效和实用性较理想的手术前用药。NEOTAX是一项2期研究,旨在研究新辅助治疗托帕里单抗联合阿西替尼治疗透明细胞肾细胞癌(ccRCC)和下腔静脉肿瘤血栓(IVC-TT)的有效性和安全性。张旭院士、马鑫教授及顾良友教授团队牵头开展了这项研究,并在Nature子刊“Signal Transduction and Targeted Therapy"中(IF:40.8)发表学术论著“Neoadjuvant toripalimab plus axitinib for clear cell renal cell carcinoma with inferior vena cava tumor thrombus: NEOTAX, a phase 2 study"。其中,研究利用Cell DIVE单细胞空间蛋白组学技术对19种marker进行9轮循环染色,将临床研究结果进行了转化研究及验证,该部分实验及分析由非因生物支持完成。
研究方案

研究结果
1.病例纳入及数据
2020年3月至2023年10月期间,该单中心研究最终入组25例接受治疗的患者(患者纳入及干预过程如图1)。其中,11例患者TT水平降低。新辅助治疗可显著降低肿瘤血栓患者的Mayo水平,其余14例患者血栓水平稳定,Mayo水平均未升高。25例患者中有14例血栓水平稳定,其中13例患者TT长度减少,TT长度的中位变化为- 2.3 cm(范围:- 7.1至1.1 cm)。新辅助治疗12周后,25例患者中有11例IVC-TT达到PR(肿瘤血栓长度缩小>30%),但Mayo水平未升高

2. 术后并发症及随访
21例患者成功行性肾切除术合并下腔静脉血栓切除术。术后并发症发生率为57.1%。最常见的轻微并发症是一过性肾功能不全和术后需要输血。3例患者出现严重并发症。1例患者出现肾衰竭,需要透析。1例患者出现心肺骤停,需要进行心肺复苏。1例患者因术中大出血而死于失血性休克和弥散性血管内凝血(V级,死亡率4.8%)。这些主要并发症均不是由TKI治疗或免疫治疗引起的。尽管这些是IBC治疗后常见的问题,但没有报道伤口愈合的并发症。在一些患者中观察到腹腔内组织粘连,但并没有导致手术复杂性显著增加或需要实行开放手术。
整个队列的中位随访时间为23.3个月,中位无进展生存期(PFS)为25.3个月。9例患者出现肿瘤进展(肿瘤复发、新转移灶出现、原转移灶进展),其中7例术后进展。1年和2年的PFS分别为89.1%和54.8%(图2d)。随访期间报告了2例死亡(8.0%),其中1例患者出现疾病进展,1例患者死于(图2c)。

3. 转化研究
作者收集了18例患者术前原发肿瘤穿刺样本,通过单细胞空间蛋白组学Cell DIVE技术对包括CD57、CD11b、CD68、PanCK、SMA、CD33、HLA-DR、CD14、CD163、CD45RO、CD68、PD-1、PD-L1、CD20、FoxP3、CD8、CD3、CD4、CD31在内的19种marker进行了循环染色。研究了潜在的分子生物标志物或免疫细胞亚群预测治疗效果。研究根据TT响应对患者进行分层(响应组N,无响应组NR),发现无响应组(NR)中细胞毒性T细胞(CD3+CD4−CD8+ CD45RO−)水平较高,其中主要源自PD-1阳性细胞(CD3+ PD1+CD4−CD8+CD45RO−)(图3a, b, c)。此外,研究发现响应组具有较少的辅助T细胞(CD3+CD4+CD8−FOXP3−CD45RO−),而其亚型:调节性T细胞(CD3+CD4+CD8− FOXP3+CD45RO−)作为另一个主要的免疫抑制T细胞并无显著变化(图3b)。以上结果说明虽然无响应组表现出较高的T细胞浸润,但这些浸润细胞可能主要是表达PD-1的免疫抑制性T细胞毒性细胞。这些表达PD-1的细胞可能与表达PD-L1的肿瘤细胞相互作用,最终导致对新辅助治疗抵抗。因此,术前评估肿瘤穿刺标本中T细胞毒性PD-1/+细胞水平可以作为治疗反应的预测指标。

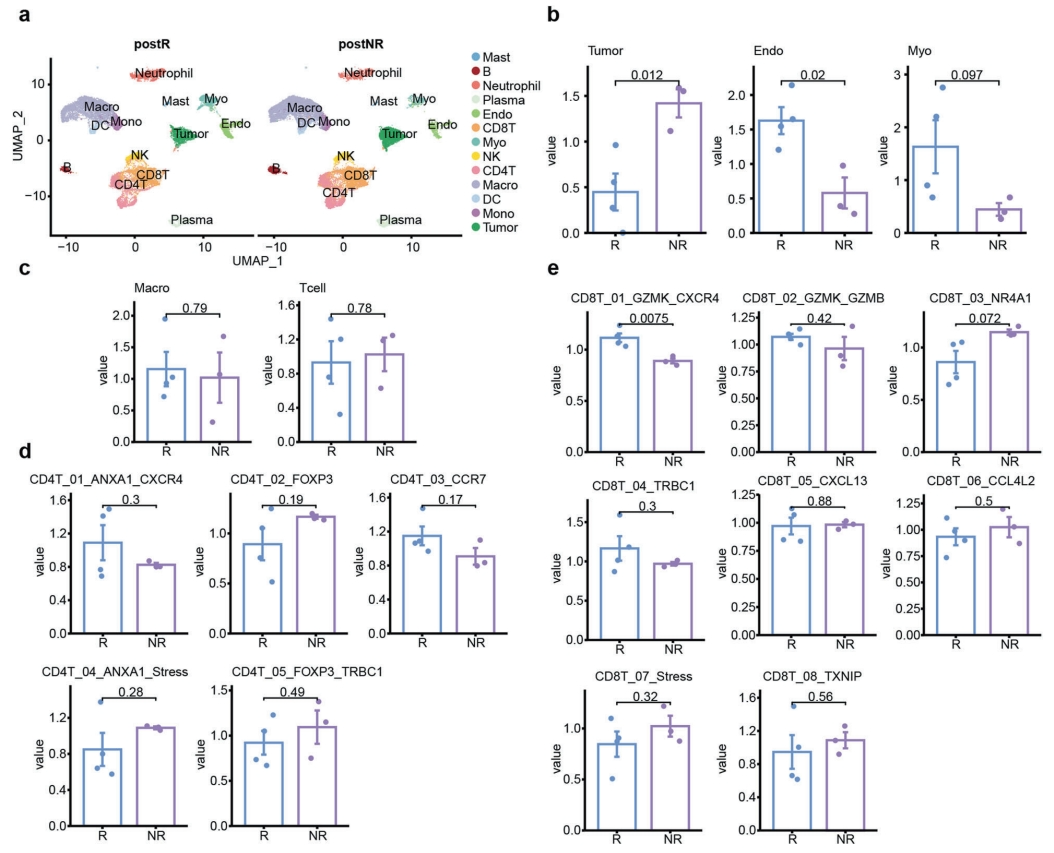
在新辅助阿西替尼治疗合并TT的RCC研究中,虽然没有观察到统计学差异,但作者发现了相似的T细胞趋势。作者利用7例患者单细胞测序(scRNA-seq,其中4例来自NR组,3例来自R组)描述了肿瘤微环境的细胞分布。经过严格的质量控制,共计获得41973个细胞,并分为13种主要细胞类型(图4a)。在NR组的非免疫细胞中,肿瘤细胞比例较高,内皮细胞和成纤维细胞比例较低(图4b),但免疫细胞无显著差异(图4c),这表明T细胞亚群与新辅助治疗的疗效有潜在的联系。对免疫细胞亚群进行进一步亚分类,结合多重免疫荧光的结果,发现T细胞的典型标记CD8T_01_GZMK_CXCR4子集发生了显著变化,而其他子集保持不变(图4d, e)。此前的研究报道了CD8+ GZMK+具有最高的细胞毒性评分和很低的衰竭评分,这与联合治疗的良好响应有关。
研究结论
这项临床2期研究表明,托利哌单抗联合阿西替尼有望降低IVC-TT的分期,并减少ccRCC和IVC-TT患者对广泛手术治疗的需求。此外,术前评估肿瘤穿刺标本中T细胞毒性PD-1/+细胞水平可以作为治疗反应的预测指标,并且T细胞亚群可能与RCC-TT患者新辅助治疗的有效性有关。
电话
微信扫一扫
